Cáncer de Ovario: Conociendo al enemigo y sus debilidades
A pesar del desarrollo tecnológico y en la medicina, existe un enemigo silencioso y sorpresivo; el cual nos muestra nuestras falencias en la detección de enfermedades en estadíos tempranos. En esta ocasión nos referimos a una neoplasia maligna: el cáncer de ovario.
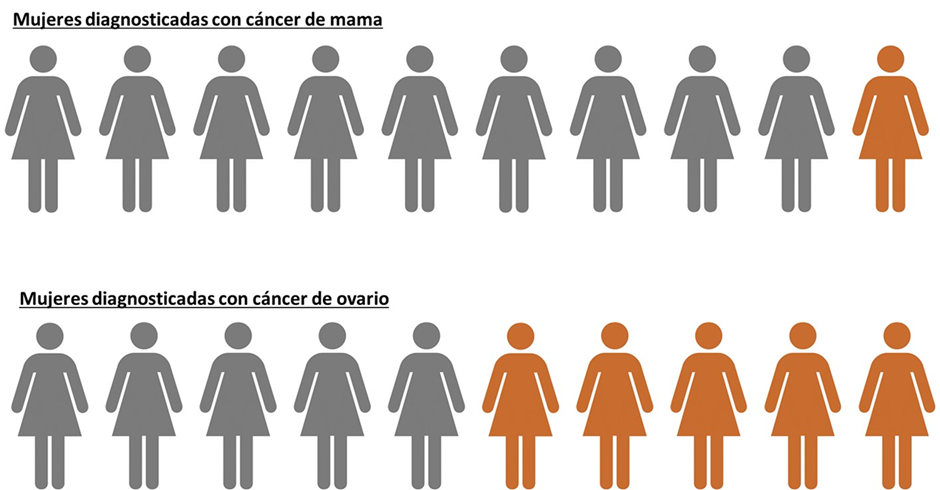
Esta enfermedad representa la neoplasia más letal dentro del grupo de patología maligna ginecológica, y esto es debido a que cuando se diagnostica, por lo general, ya se encuentra en etapas avanzadas. Por ejemplo, si comparamos una mujer con reciente diagnóstico de cáncer de ovario, con otra con cáncer de mama, alrededor la mitad del grupo con la primera neoplasia vivirán en los próximos 5 años, mientras que la mayoría de mujeres con neoplasia maligna mamaria seguirán vivas en los 5 años de evaluación luego de su diagnóstico(1,2). Sin embargo, el estadío–cuánto ha avanzado o invadido el organismo –modificaría las estadísticas de supervivencia en estos 5 años de evaluación posterior al diagnóstico (Puede revisar la Figura 1).
Por este motivo, detectar el cáncer de ovario en etapas tempranas es crucial para luchar contra esta dolencia. Uno de los marcadores que suele utilizarse con la intención de detectar o evaluar el progreso de cáncer de ovario es el biomarcador (molécula que recorre la sangre) antígeno de cáncer 125 (CA-125). Un reciente estudio con seguimiento de más de 200,000 mujeres del Reino Unido utilizó medidas de tamizaje periódicas como el CA-125 en la mitad de su población de 50 a 74 años, y sin antecedente de neoplasia ni cirugía en ovarios o de trompas de Falopio.
Sin embargo, en este estudio prospectivo de 20 años de seguimiento, no se pudo evidenciar un impacto alto del CA-125 para detectar casos en estadíos tempranos de cáncer de ovario; ya que usando las medidas de cribado – CA-125 y ecografía transvaginal– solo pudieron aumentar la detección de cáncer en el grupo de estadios tempranos en un 10%, en contraste con las mujeres sin los tamizajes anuales(3). Esto podría deberse a que el cáncer de ovario en estadios tempranos tiene pocas células o material relacionado (e.g. CA-125, ADN, ARN) circulando en la sangre de las mujeres con cáncer temprano de ovario.
Etiología del Cáncer de Ovario
El conocimiento de la etiología del cáncer de ovario ha cambiado en las últimas dos décadas, ya que antes se pensaba que la mayoría de casos se originaban de los ovarios per se. Sin embargo, estudios anatomopatológicos demostraron que la mayoría de casos de cáncer de ovario tenían un componente en las trompas de Falopio, en específico la parte distal que está más próxima a los ovarios(5). Este cambio de paradigma primero se reportó en pacientes con predisposición genética al cáncer de ovario (e.g. portadoras de alteraciones genéticas germinales en BRCA1 ó BRCA2); para luego estudiarse en pacientes mujeres sometidas a alguna intervención quirúrgica: neoplásica o no neoplásica. Asimismo, en general se estima que el aproximadamente 60% de los casos de cáncer de ovario sean de etiología desde las trompas de Falopio (6,7).
Tanto se avanzó en este tema que existen ensayos clínicos ya culminados(8) y en curso(7) –la continuación de los estudios evaluando una cirugía de ovario retrasada– donde las mujeres portadoras de mutaciones genéticas germinales que predisponen al cáncer, sean sometidas a dos alternativas: 1) procedimiento quirúrgico convencional (donde se extirpa ovarios y trompas de Falopio), y la otra opción escalonada de, 2) primero extirpar las trompas de Falopio y luego a la edad de menopausia, proponer la exéresis de los ovarios. Esta medida se propone por los efectos secundarios de retirar los ovarios en una paciente joven sin cáncer, pero con riesgo alto de cáncer de este órgano: bochornos, descensos vaginales, depresión, ansiedad, alteración endocrina o incremento de la probabilidad de enfermedad cardiovascular, entre otros(9).
Una vez conocido el origen, y lo importante de la etiología para poder hacer un tratamiento más personalizado, también es importante conocer los riesgos y cómo la terapia se va convirtiendo en más precisa y personalizada. Además de los factores epidemiológicos como edad, exceso de peso, nuliparidad o gestación tardía, y el uso de terapia hormonal luego de menopausia; este texto dará un énfasis en los hallazgos de medicina de precisión. Para esto, primero tenemos que entender que existen dos tipos de mutaciones, en simples palabras: germinales y somáticas.
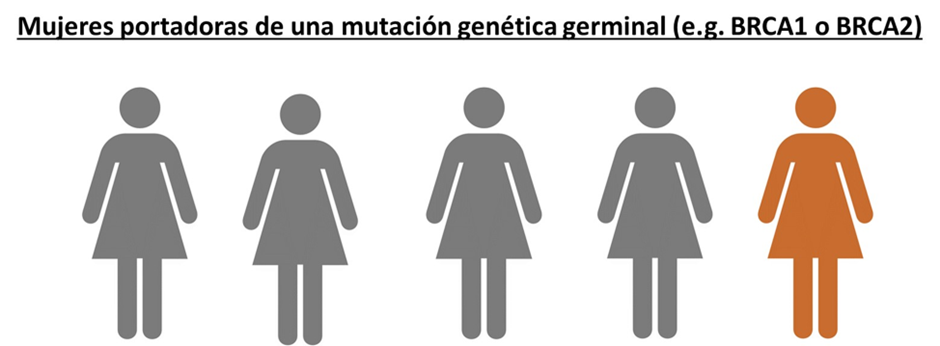
En el primer grupo están las personas que nacieron con una mutación en un gen, lo cual les predispone a tener un riesgo más elevado a padecer cáncer en toda su vida; comparado con el riesgo de cáncer en la población en general. En cáncer de ovario, se estima que 25% de los casos de cáncer de ovario tienen una predisposición genética (Figura 2). Por lo tanto, estas pacientes deben ser evaluadas de rutina mediante paneles y asesoría genéticos y trabajo multidisciplinario(4). Las decisiones son difíciles en estas pacientes, como por ejemplo extirpar las trompas o los ovarios, así como estudiar a los familiares si también son portadores de la misma mutación, así como los hallazgos genéticos en un probable síndrome de predisposición genética al cáncer o cáncer hereditario(10).
El otro tipo de mutación ocurre solo en el tejido, en este caso puede ser en el ovario o en la trompa, o ambos–así como en las metástasis del tumor primario. Un ejemplo es la mutación de genes reparadores del ADN, como lo son BRCA1 o BRCA2, para lo cual ya existe un manejo aprobado por las instancias internacionales. Uno de los ejemplos es el uso de los inhibidores de la enzima llamada poli(ADP)-ribosa-polimerasa(PARP).
Las proteínas BRCA1 o BRCA2 están comprometidas en la reparación de un tipo de daño celular llamado ruptura de doble cadena de ADN–recordemos que el ADN tiene dos hebras o cadenas antiparalelas. Por otro lado, PARP está involucrada en la reparación de una ruptura de cadena simple de ADN. Es lógico pensar que, si fallan los mecanismos para reparar un daño en una cadena de ADN, el siguiente paso sería el daño en las dos hebras. Y esta es la debilidad de los tumores que tienen mutaciones en genes reparadores del daño de doble cadena como el BRCA1 o BRCA2.
BRCA1 y BRCA2 – entre otros en la vía de reparación homóloga de daño de doble cadena–son supresores tumorales, lo que quiere decir que frenan el ciclo celular para reparar el ADN. De esta manera, si estas proteínas fallan, los tumores podrían sobrevivir indefinidamente sin la necesidad de reparar el ADN en estados óptimos; como se repara en estos momentos que usted lee este documento.
Una vez que proteínas como BRCA1 o BRCA2 fallan, solo quedarían mecanismos compensatorios como el de PARP. Por lo tanto, si existiera una mutación o bloqueo en PARP, la célula tendría demasiado estrés genotóxico como para sobrevivir, incluso si es cancerígena y por lo tanto resistente a muchos factores. Así, se han generado medicamentos que pueden bloquear la función reparadora de PARP. Esta debilidad ha sido estudiada y validada con estudios experimentales tanto preclínicos como en humanos, y se le conoce como letalidad sintética: es decir inducir a que las células con un tipo de mutación (e.g. como en BRCA1 o BRCA2) se inclinen a la muerte.
Una de las drogas típicas de letalidad sintética en cáncer de ovario es el Olaparib(11) y sus derivados. Actualmente se puede usar si existe mutación tanto somática (en el tejido tumoral) como en mujeres portadoras de mutaciones germinales (e.g. BRCA1 o BRCA2) y con cáncer de ovario. Se estima que más medicamentos puedan ser usados dependiendo de la alteración de los genes involucrados –otros diferentes de BRCA1 o BRCA2–y también otros marcadores moleculares y genómicos(12).
Las medidas diagnósticas y terapéuticas en cáncer de ovario han evolucionado en estas dos últimas décadas, sin embargo aún hay camino por mejorar para una detección temprana de esta neoplasia maligna. Algunas medidas promisorias podrían ser el uso de biopsia líquida, donde material genómico e incluso epigenómico (e.g. perfil de metilación o mi-ARN) pueden detectarse con una simple pero periódica muestra de sangre extraída desde el brazo. Sin embargo, la limitante sería que el cáncer de ovario en estadios iniciales contiene pocas células, y por lo tanto sería de difícil detección con biopsia líquida. Aunque existen actualmente grupos de investigadores, clínicos y empresarios tratando de mejorar las tecnologías para captar cada vez más cantidades pequeñas de carga tumoral, sea celular o material más pequeño como ADN, ARN entre otros(13).
Seremos testigos en las siguientes décadas de la mejoría en la detección y prevención desde estadios iniciales con tecnologías como la biopsia líquida hasta con prevención primaria, como ya se hace para portadoras de mutaciones germinales en genes como BRCA1 y BRCA2; y riesgos poligénicos. Esta última herramienta difiere de los estudios de cáncer hereditario que ya se brindan en la práctica clínica diaria, en la concepción de riesgos conferidos por un grupo de genes asociados al cáncer.
Estos pesos de asociación dado por los polimorfismos de nucleótido simple (PNS) de estos genes (perfil genético) son complementados con otras características de la mujer (e.g. edad, peso, nivel socioeconómico) para obtener un puntaje, el cual luego un proceso de validación y calibración, puede categorizar el riesgo de una mujer al azar en una población de padecer de cáncer de ovario(14,15). Actualmente no existe ninguna herramienta poligénica en cáncer de ovario con suficiente evidencia para su uso clínico, pero en un futuro podría presentarse.
Conclusión
En este ensayo se describe lo difícil del diagnóstico y manejo de cáncer de ovario, así como los avances en los últimos años relacionados a una mejor atención. Como sucede con los conceptos actuales en medicina (i.e. medicina de precisión) –y más notorio en oncología– existe la necesidad de invertir en tecnologías sanitarias y recursos apropiadamente capacitados para poder brindar a las pacientes con cáncer de ovario las futuras medidas de diagnóstico, prevención y manejo. Tomará tiempo, aunque lo principal recae en la voluntad política para hacer sostenible esta intención, sobre todo en países latinoamericanos(16).
El cáncer de ovario así como otras dolencias de difícil diagnóstico (e.g. cáncer de estómago, páncreas), en un futuro próximo–en algunos casos ya sucede en la práctica clínica habitual–podrían detectarse tempranamente y tratar personalizadamente con terapias dirigidas como la letalidad sintética o inmunoterapia. Así, se podrá mejorar la tasa de supervivencia y la calidad de vida de las mujeres con este enemigo silencioso y sorpresivo.
Referencias
- Hodson R. Ovarian cancer. Nature. 2021 Dec 16;600(7889):S35–S35.
- American Cancer Society. Survival Rates for Ovarian Cancer [Internet]. Survival Rates for Ovarian Cancer. [cited 2022 Apr 26]. Available from: https://www.cancer.org/cancer/ovarian-cancer/detection-diagnosis-staging/survival-rates.html
- Menon U, Gentry-Maharaj A, Burnell M, Singh N, Ryan A, Karpinskyj C, et al. Ovarian cancer population screening and mortality after long-term follow-up in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial. The Lancet. 2021 Jun;397(10290):2182–93.
- American Cancer Society. Ovarian Cancer Risk Factors [Internet]. Ovarian Cancer Risk Factors. [cited 2022 Apr 26]. Available from: https://www.cancer.org/cancer/ovarian-cancer/causes-risks-prevention/risk-factors.html
- Lee Y, Miron A, Drapkin R, Nucci M, Medeiros F, Saleemuddin A, et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. J Pathol. 2007 Jan;211(1):26–35.
- Tone AA, Begley H, Sharma M, Murphy J, Rosen B, Brown TJ, et al. Gene Expression Profiles of Luteal Phase Fallopian Tube Epithelium from BRCA Mutation Carriers Resemble High-Grade Serous Carcinoma. Clin Cancer Res. 2008 Jul 1;14(13):4067–78.
- DeWeerdt S. The origins of ovarian cancer. Nature. 2021 Dec 16;600(7889):S42–4.
- Steenbeek MP, Harmsen MG, Hoogerbrugge N, de Jong MA, Maas AHEM, Prins JB, et al. Association of Salpingectomy With Delayed Oophorectomy Versus Salpingo-oophorectomy With Quality of Life in BRCA1/2 Pathogenic Variant Carriers: A Nonrandomized Controlled Trial. JAMA Oncol. 2021 Aug 1;7(8):1203.
- Erekson EA, Martin DK, Ratner ES. Oophorectomy: the debate between ovarian conservation and elective oophorectomy. Menopause. 2013 Jan;20(1):110–4.
- Toss A, Tomasello C, Razzaboni E, Contu G, Grandi G, Cagnacci A, et al. Hereditary Ovarian Cancer: Not Only BRCA 1 and 2 Genes. BioMed Res Int. 2015;2015:1–11.
- Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). FDA approved olaparib (LYNPARZA, AstraZeneca Pharmaceuticals LP) for the maintenance treatment of adult patients with deleterious or suspected deleterious germline or somatic BRCA-mutated (gBRCAm or sBRCAm) advanced epithelial ovarian, fallopian tube or primary peritoneal cancer who are in complete or partial response to first-line platinum-based [Internet]. 2018 [cited 2022 Apr 26]. Available from: https://www.fda.gov/drugs/fda-approved-olaparib-lynparza-astrazeneca-pharmaceuticals-lp-maintenance-treatment-adult-patients
- Setton J, Zinda M, Riaz N, Durocher D, Zimmermann M, Koehler M, et al. Synthetic Lethality in Cancer Therapeutics: The Next Generation. Cancer Discov. 2021 Jul 1;11(7):1626–35.
- Bhardwaj BK, Thankachan S, Venkatesh T, Suresh PS. Liquid biopsy in ovarian cancer. Clin Chim Acta. 2020 Nov;510:28–34.
- 14. Barnes DR, Rookus MA, McGuffog L, Leslie G, Mooij TM, Dennis J, et al. Polygenic risk scores and breast and epithelial ovarian cancer risks for carriers of BRCA1 and BRCA2 pathogenic variants. Genet Med. 2020 Oct;22(10):1653–66.
- Dareng EO, Tyrer JP, Barnes DR, Jones MR, Yang X, Aben KKH, et al. Polygenic risk modeling for prediction of epithelial ovarian cancer risk. Eur J Hum Genet. 2022 Mar;30(3):349–62.
- Abdiel Alejandro Torres-Grimaldo. Personalised Healthcare in Latin America- Universalising the promise of innovation. 2020 [cited 2022 Apr 26]; Available from: http://rgdoi.net/10.13140/RG.2.2.32884.58242
Imagen destacada: Cancer Research UK, Adaptada de Wikimedia Commons.
Artículos más recientes

Augusto Sola: Piedra Angular en la Neonatología Latinoamericana
10/Nov/2025

La Última Lección de Julieta Fierro: Ciencia, Retos y la Felicidad Perpetua
10/Nov/2025

Aldo Bartra: detrás del Robot de Platón
07/Nov/2025

Antonio Lazcano: Precusor en la teoría del origen de la vida
07/Nov/2025

El resurgimiento de los Dinosaurios
27/Sep/2024

Expedición a los parques: bitácora de un explorador
25/Sep/2024

Ingeniería genética en los alimentos
23/Sep/2024